 В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). Закон Авогадро означает, что давление газа при определенной температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации.
В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). Закон Авогадро означает, что давление газа при определенной температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации.
Существуют и другие агрегатные состояния, например, конденсат Бозе — Эйнштейна. Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов, которая достигается наличием дальнего порядка и носит название кристаллической решётки.

Жидкое состояние обычно считают промежуточным между твёрдым телом и газом. Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Как правило, вещество в жидком состоянии имеет только одну модификацию. Составление в мезофазы происходит благодаря особой форме молекул жидких кристаллов.
Промежутки между молекулами газа очень большие. Молекулы газа обладают очень слабыми связями. Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Газ заполняет всё доступное пространство и проникает в любые его закоулки.
С микроскопической точки зрения газ — это состояние вещества, в котором его отдельные молекулы взаимодействуют слабо и движутся хаотически. По химическим свойствам газы и их смеси весьма разнообразны — от малоактивных инертных газов до взрывчатых газовых смесей.
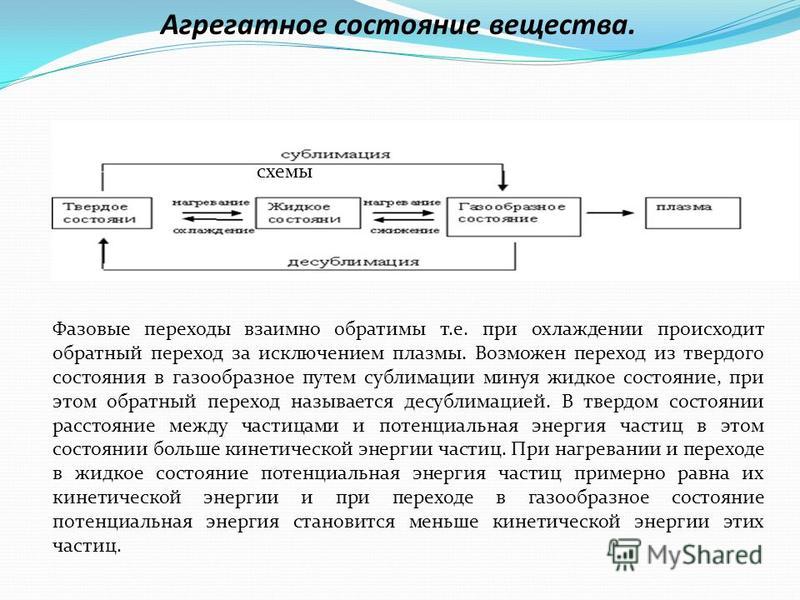
Газам свойственна изотропия, то есть независимость характеристик от направления. Переход вещества из одной термодинамической фазы в другую при изменении внешних условий. Фазовое состояние, в которое переходят некоторые вещества при определённых условиях (температура, давление, концентрация в растворе).

Поэтому было разработано большое число точных уравнений состояния для конкретных газов в диапазоне определенных температур и давлений
Наиболее характерным свойством ЖК является их способность изменять ориентацию молекул под воздействием электрических полей, что открывает широкие возможности для применения их в промышленности. В свою очередь нематики подразделяются на собственно нематические и холестерические жидкие кристаллы. Поскольку атомыгелия являются бозонами, квантовая механика допускает нахождение в одном состоянии произвольного числа частиц. Вблизи абсолютного нуля температур все атомы гелия оказываются в основном энергетическом состоянии.

Считается также, что в эволюции Вселенной состояние глазмы предшествовало кварк-глюонной плазме, которая существовала в первые миллионные доли секунды сразу после Большого взрыва. При глубоком охлаждении некоторые (далеко не все) вещества переходят в сверхпроводящее или сверхтекучее состояние. Газ, на свойства которого существенно влияют квантовомеханические эффекты, возникающие вследствие тождественности его частиц.
Всё свидетельствует о том, что сверхтекучий гелий – это в действительности тоже газ, и аналогия с электронным газом полная
Состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки, является сверхкритической жидкостью.
Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах. Наибольший интерес и распространение в связи с определёнными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода.
МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы.
При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно. В природе имеются некоторые жидкости, которые в обычных условиях эксперимента невозможно перевести при охлаждении в кристаллическое состояние.
Однако, некоторые газы — водород, кислород, азот, окись углерода и метан не переходили в жидкое состояние даже при температуре минус 110°С и давлении 50 атмосфер
Шульц М. М., Мазурин О. В. Современное представление о строении стёкол и их свойствах. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Также термин «газ» можно определить как вещество, температура которого равна или превышает критическую точку, при такой температуре сжатие газа не приводит к образованию жидкости.
Идеальный газ — газ, в котором взаимодействие между молекулами сводится к парным столкновениям, причём время межмолекулярного столкновения намного меньше среднего времени между столкновениями.
Наиболее простым и распространённым является уравнение Ван-дер-Ваальса. Некоторые из этих уравнений часто строятся методами теории возмущений, при этом отличие от уравнения состояния идеального газа описывается набором вириальных коэффициентов.

Поскольку газ в баллоне находится под высоким давлением, очень важно, чтобы все соединения были герметичны и не «травили»
Важнейшим свойством этого газа является существование в такой простой модели фазового перехода газ — жидкость. Частично или полностью ионизованный газ называется плазмой (иногда называется следующим агрегатным состоянием). Основной особенностью газа является то, что он заполняет всё доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ — изотропное вещество, то есть его свойства не зависят от направления.
В поле сил тяготения плотность и давление не одинаковы в каждой точке, уменьшаясь с высотой по барометрической формуле. Газ имеет высокую сжимаемость — при увеличении давления возрастает его плотность. Критическая температура является характеристикой конкретного газа и зависит от сил взаимодействия между его молекулами. В определенном диапазоне температур и давления газовая и жидкая фаза одного и того же вещества могут сосуществовать.

Эти нейтральные частицы газа изменяют направление только тогда, когда они сталкиваются с другими частицами или стенками ёмкости. Все предпосылки, лежащие в этой теории, можно найти в разделе «Основные постулаты» кинетической теории. Важнейшей чертой теплового движения молекул газа — это беспорядочность (хаотичность) движения. Экспериментальным доказательством непрерывного характера движения молекул является диффузия и броуновское движение.
В результате взаимной диффузии веществ происходит постепенное выравнивание их концентрации во всех областях занимаемого ими объёма. Установлено, что скорость протекания процесса диффузии зависит от рода веществ и температуры. Беспорядочность перемещения таких частиц объясняется случайным характером передачи импульсов от молекул газа частице с разных сторон.
Как и газ, жидкости тоже в основном изотропные. Переход из твёрдого состояния в газообразное, минуя жидкое, называют сублимацией или возгонкой. Молекулы в газе могут перемещаться свободно и быстро. Это укрепляло уверенность в том, что газы и жидкости имеют разную природу.
 В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). Закон Авогадро означает, что давление газа при определенной температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации.
В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). Закон Авогадро означает, что давление газа при определенной температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. 










