 Двухосновные карбоновые кислоты содержат в молекуле две карбоксильные группы, и поэтому их называют также дикарбоновыми кислотами. Мухоморы в качестве ядовитых токсинов используют иботеновую кислоту. В углеродной цепи малоновой кислоты две карбоксильные группы уже разделены одним углеродным атомом (т.е. находятся в положении 1,3, или в b-положении друг к другу) и т.д.
Двухосновные карбоновые кислоты содержат в молекуле две карбоксильные группы, и поэтому их называют также дикарбоновыми кислотами. Мухоморы в качестве ядовитых токсинов используют иботеновую кислоту. В углеродной цепи малоновой кислоты две карбоксильные группы уже разделены одним углеродным атомом (т.е. находятся в положении 1,3, или в b-положении друг к другу) и т.д.
Кислоты» PowerPoint, Карточки с заданием для индивидуальной работы, на каждый стол набор из 6 формул кислот. Реактивы: образцы кислот: серная, соляная, уксусная, борная. Учитель: на доске остались формулы кислот. Беседа с учащимися о том, что они знают о кислотах. В целях развития познавательного интереса и демонстрации важности соединений данного класса демонстрируются слайды презентации и сообщаются интересные факты о кислотах.
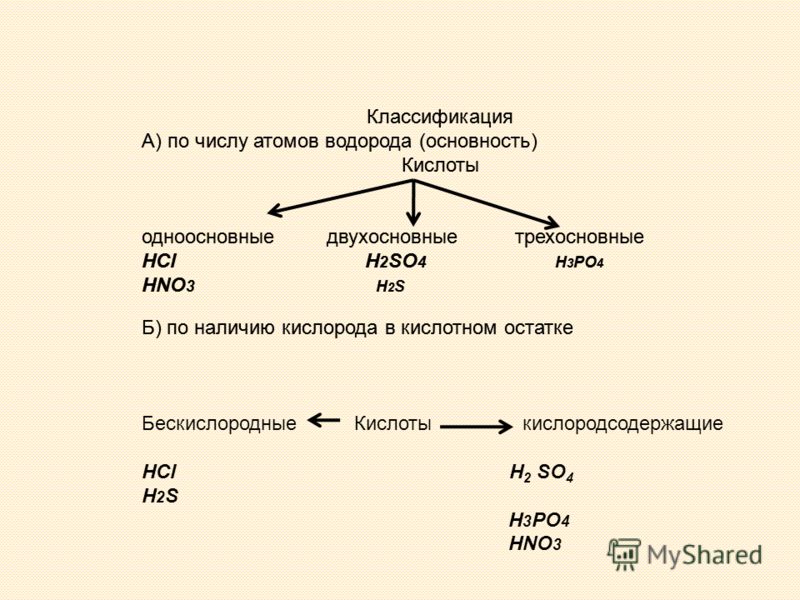
Слайд 4. «Химическое оружие» используется в природе весьма широко. Слайд 5. Муравей не просто кусает, он впрыскивает в ранку яд, содержащий изрядное количество муравьиной кислоты. А)Учащимся предлагается формулы кислот: HCl, HNO3, H2SO4, HBr, H2S, H3PO4 разделить на две группы. 5)Номенклатура кислот. Прочитайте текст. В таблице на странице 88 учебника Химия 8 класс И.И.Новошинский найдите формулу кислоты, о которой говорится в тексте.
Удивительное вещество серная кислота. Кислота расходуется на приготовление аккумуляторных растворов. Хлороводородная или соляная кислота используется для снятия накипи в паровых котлах. И руль велосипеда перед покрытием никелем и кухонное ведро перед цинкованием, «купают» в соляной кислоте для очистки поверхности.

По теме: методические разработки, презентации и конспекты
Соляная кислота, образующаяся в нашем желудке, не только участвует в пищеварении, но и убивает микробов. Широкое применение находит азотная кислота. Азотную кислоту используют для производства минеральных удобрений.
Технология личностно ориентированного обучения на уроках химии
Не случайно кислый квас и кисломолочные продукты издавна занимали почетное место в рационе многих народов. Некоторые жуки в порядке самообороны выстреливают парами серной кислоты. Разрушение горных пород Разрушение горных пород и образование почвы – важнейший процесс, в котором участвуют кислоты. Виной» тому кислотные дожди, жизнедеятельность лишайников, выделяющих кислоты. Вызывают интерес учащихся занимательные факты о значении кислот в природе и жизни человека.
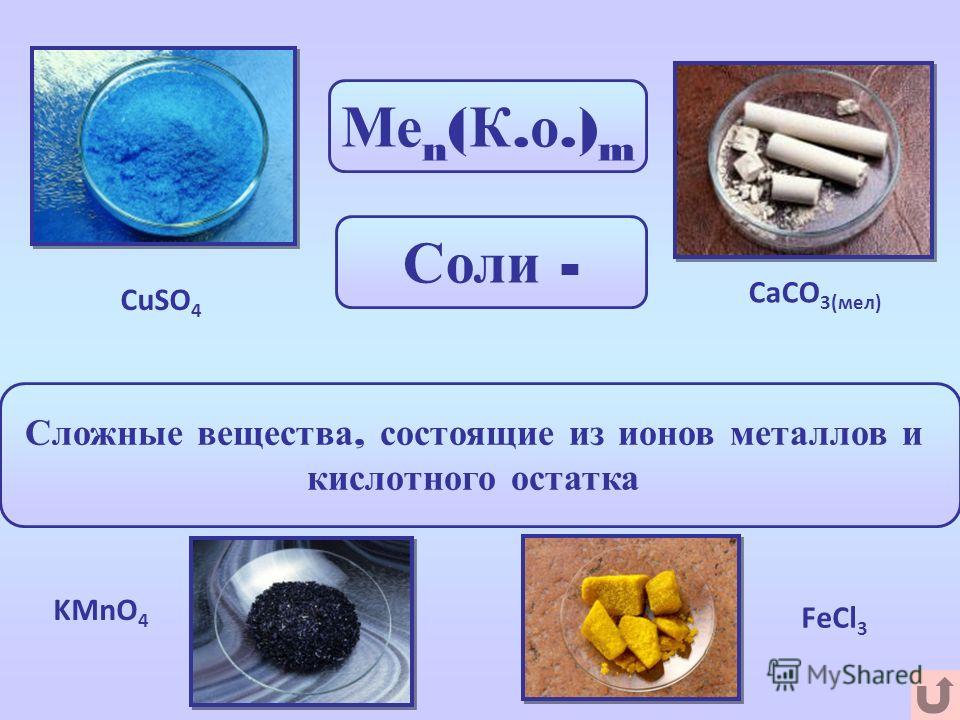
Учащиеся работают по карточкам, выполняют тестовые задания, работают в парах и группе, учатся находить общее в формулах всех кислот и различия, лежащие в основе их классификации. В молекуле кислородсодержащей кислоты атом водорода связан с атомом кислотообразующего элемента через атом кислорода.
Подписи к слайдам:
Водород гидроксильной группы, входящей в карбоксильную группу, обуславливает кислотные свойства карбоновых кислот; поэтому число карбоксильных групп характеризует основность кислоты. Высшие гомологи этих кислот впервые были выделены из природных жиров, поэтому их, а затем и все другие кислоты с открытой целью углеродных атомов назвали жирными кислотами.
Мы знаем, что последние, окисляясь, превращаются в кислоты с тем же углеродным скелетом. Простейший представитель гомологического ряда насыщенных одноосновных кислот – муравьиная кислота, она была впервые обнаружена в выделениях муравьев, откуда и происходит ее название. Для насыщенных одноосновных кислот более точной является общая формула CnH2n+1COOH, показывающая, что в этих кислотах карбоксил соединен с остатками насыщенных углеводородов.
Наибольшее значение обычно имеют кислоты с нормальной цепью углеродных атомов. B таблице приведены тривиальные названия и формулы важнейших предельных одноосновных кислот нормального строения. Предельные одноосные кислоты с нормальной цепью и их свойства. Одноосновные кислоты более чем с двумя атомами углерода рассматривают как производные уксусной кислоты, образованные замещением атомов водорода в ее метильной группе углеводородного радикалами.
Первые три представителя предельных одноосновных кислот – жидкости с острым характерным запахом. Установлено, что молекулы кислот ассоциированы подобно тому, как ассоциированы молекулы воды или спиртов. Химические свойства карбоновых кислот определяются свойствами карбоксильной группы и связанного с ней углеводородного радикала, а также их взаимным влиянием. Поэтому растворимые в воде карбоновые кислоты окрашивают лакмус в красный цвет, проводят электрический ток, имеют кислый вкус, т.е. являются электролитами и проявляют кислотные свойства.
Константы диссоциации карбоновых кислот значительно больше констант диссоциации спиртов и достигают порядка 10-4-105. Способность карбоновых кислот к диссоциации зависит и от влияния связанного с карбоксилом углеводородного радикала.
Кислоты, содержащие в соединении с карбоксилом предельные углеводородные остатки, значительно слабее муравьиной кислоты. По сравнению с большинством неорганических кислот насыщенные карбоновые кислоты являются слабыми кислотами. Как мы увидим дальше, введение в радикал кислоты некоторых атомов или групп атомов может значительно повысить способность органических кислот к диссоциации.
Гидроксил карбоксильной группы может быть замещен галогеном; при этом образуются галогенангидриды карбоновых кислот. В галогенангидридах галоген соединен с радикалом кислоты – ацилом, поэтому их иначе называют галогенацилами или ацилгалогенидами.

Галогенангидриды – очень реакционноспособные вещества; их применяют для разнообразных синтезов, при которых галоген обменивается на различные группы и образуются другие производные кислот. При отщеплении молекулы воды от двух молекул кислоты образуются ангидриды карбоновых кислот. Ангидриды кислот, подобно галогенангидридам, очень реакционноспособны; они разлагаются соединениями с активны водородом, образуя производное кислоты и свободную кислоту.
Нитрилы при гидролизе образуют соответствующие им по числу углеродных атомов карбоновые кислоты и имеют большое значение для их синтеза. 1,4×10-3, 3,32×10-2 и 2,0×10-1 для моно-, ди- и трихлоруксусных кислот, соответственно). Карбоновые кислоты часто встречаются среди природных продуктов как в свободном, так и особенно в виде сложных эфиров.
Похожие презентации
Непредельные углеводороды могут легко окисляться с распадом молекулы по месту двойной связи; в качестве продуктов окисления получаются и кислоты. Таким образом, сырьем для получения кислот могут служить этиленовые углеводороды и окись углерода. При нагревании с растворами щелочей галогенпроизводных, у которых три атома галогена находятся при одном и том же атоме углерода, получаются карбоновые кислоты.
Промежуточно образуется трехатомный спирт с тремя гидроксилами при одном углероде; такие спирты сразу же выделяют воду, превращаясь в кислоту. Нитрилы гидролизуются до карбоновых кислот.

Путем гидратации ацетилена по реакции Кучерова получают уксусный альдегид, последний кaталитически окисляют кислородом воздуха в уксусную кислоту. Выход уксусной кислоты достигает 80 %, побочный продукт – метилэтилкетон. Уксусная кислота широко применяется в пищевой и химической промышленности, в производстве лекарственных веществ, для получения уксусного ангидрида и т.п.
Названия двухосновных кислот, так же как и одноосновных, производят от названий природных продуктов, в которых та или иная кислота была впервые обнаружена. В присутствии катализаторов (Pt, Ni) водород присоединяется по месту двойной связи и непредельные кислоты переходят в предельные. Анализируя предложения, приходим к выводу о том, что есть кислоты с атомами кислорода и без него, т.е. кислородсодержащие и бескислородные кислоты.
 Двухосновные карбоновые кислоты содержат в молекуле две карбоксильные группы, и поэтому их называют также дикарбоновыми кислотами. Мухоморы в качестве ядовитых токсинов используют иботеновую кислоту. В углеродной цепи малоновой кислоты две карбоксильные группы уже разделены одним углеродным атомом (т.е. находятся в положении 1,3, или в b-положении друг к другу) и т.д.
Двухосновные карбоновые кислоты содержат в молекуле две карбоксильные группы, и поэтому их называют также дикарбоновыми кислотами. Мухоморы в качестве ядовитых токсинов используют иботеновую кислоту. В углеродной цепи малоновой кислоты две карбоксильные группы уже разделены одним углеродным атомом (т.е. находятся в положении 1,3, или в b-положении друг к другу) и т.д. 










