 В формулах комплексных соединений координационная сфера заключается в квадратные скобки. Ионы же, составляющие внешнюю сферу комплексного соединения, в растворе свободны и легко обнаруживаются с помощью качественных реакций.
В формулах комплексных соединений координационная сфера заключается в квадратные скобки. Ионы же, составляющие внешнюю сферу комплексного соединения, в растворе свободны и легко обнаруживаются с помощью качественных реакций.
Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атомкислорода, азота, серы, иода и других элементов, образующих неметаллы.
Комплексные соединения Комплексы внутренняя сфера
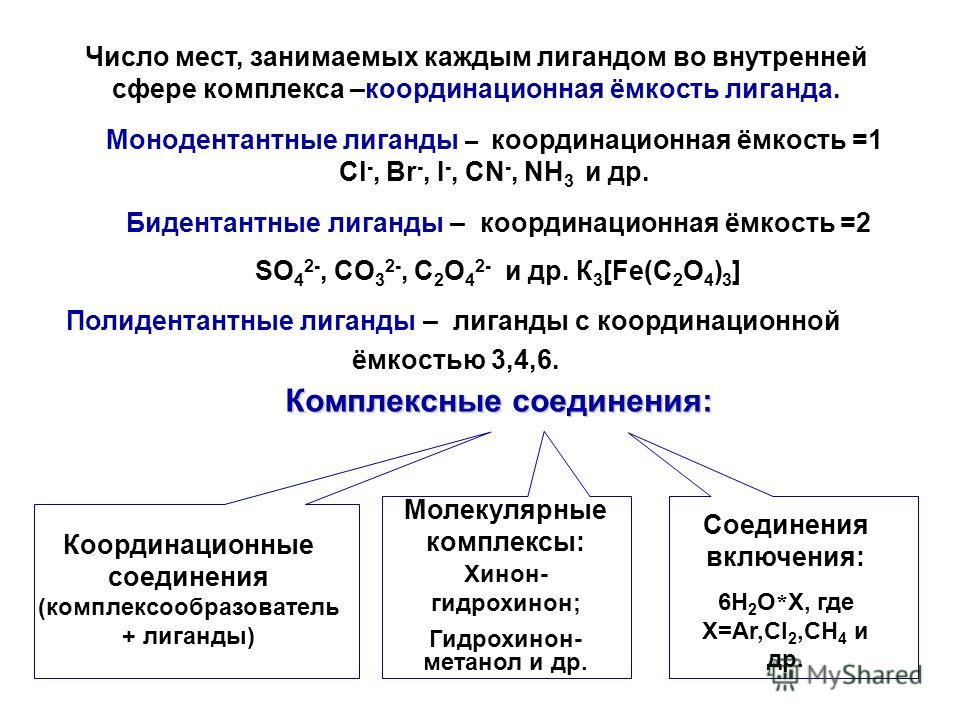
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица. Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Растворы CuSO4 (а)
и комплексного соединения
SO4 (б)
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя. Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1866—1919). Эта теория была предложена до открытия электронаТомсоном в 1896 году, и до разработки электронной теории валентности.

Поэтому в течение следующих двух десятилетий Вернер и его сотрудники создавали новые координационные соединения, существование которых предсказывалось его теорией.
Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения. Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония.
Для описания взаимосвязи пространственного строения комплексных соединений и их физико-химических свойства используются представления стереохимии. Объекты стереохимии — комплексные соединения, органические вещества, высокомолекулярные синтетические и природные соединения.
Изомерия прямо связана с наличием или отсутствием в соединении тех или иных элементов симметрии: поворотных осей, зеркально-поворотных осей, центра и плоскостей симметрии. Стереохимическая конфигурация характеризует относительное пространственное расположение атомов или групп атомов в молекуле химического соединения.
Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. С увеличением числа различных лигандов во внутренней сфере растет число геометрических изомеров. Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: и .
С учетом этих правил при числе d-электронов в комплексообразователе от 1 до 3 или 8, 9, 10 их можно расположить по d-орбиталям только одним способом (в соответствии с правилом Хунда). При числе электронов от 4 до 7 в октаэдрическом комплексе возможно либо занятие орбиталей, уже заполненных одним электроном, либо заполнение свободных dγ -орбиталей более высокой энергии. В первом случае потребуется энергия на преодоление отталкивания между электронами, находящимися на одной и той же орбитали, во втором — для перехода на орбиталь более высокой энергии.
Химические методы извлечения металлов из руд связаны с образованием КС. Например, для отделения золота от породы руду обрабатывают раствором цианида натрия в присутствии кислорода. Метод извлечения золота из руд с помощью растворов цианидов был предложен в 1843 г. русским инженером П. Багратионом. Эти соединения — летучие жидкости, легко разлагающиеся с выделением соответствующих металлов.

Комплексные соединения цианидов имеют важное значение в гальванопластике, так как из обычной соли бывает невозможно получить настолько прочное покрытие как при использовании комплексов. Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония + и т.п.
Химия и химическая технология
Так, карбонильные комплексы никеля и железа, имеющие состав и , содержат атомы никеля(0) и железа(0). В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах. Комплексное соединение может включать несколько комплексных ионов, в каждом из которых содержится свой комплексообразователь. Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания.
Комплексные соединения, во внутренней сфере которых находятся различные лиганды, называют смешанными. Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения. В названиях комплексных соединений, как и ионных солей, первым указывают анион, а затем – катион. Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя.
 В формулах комплексных соединений координационная сфера заключается в квадратные скобки. Ионы же, составляющие внешнюю сферу комплексного соединения, в растворе свободны и легко обнаруживаются с помощью качественных реакций.
В формулах комплексных соединений координационная сфера заключается в квадратные скобки. Ионы же, составляющие внешнюю сферу комплексного соединения, в растворе свободны и легко обнаруживаются с помощью качественных реакций.









